
在国家药监局办理说明书更改告知申请条件及流程
已注册医疗器械 在什么情况下需要申请医疗器械说明书更改告知呢? 一、说明书更改告知 已注册医疗器械的说明书,除注册证及其附件载明事项之外的其他内容发生变化,不属于变更注册范围内的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比
已注册医疗器械在什么情况下需要申请医疗器械说明书更改告知呢?
一、说明书更改告知
已注册医疗器械的说明书,除注册证及其附件载明事项之外的其他内容发生变化,不属于变更注册范围内的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。
办理说明书更改告知需满足以下条件:
已注册医疗器械的说明书
除注册证及其附件载明事项之外的其他内容发生变化
不属于变更注册范围内的
二、三种审查结果
同意
不同意
部分同意
三、医疗器械说明书更改告知办理流程图
一、说明书更改告知
已注册医疗器械的说明书,除注册证及其附件载明事项之外的其他内容发生变化,不属于变更注册范围内的,应当向医疗器械注册的审批部门书面告知,并提交说明书更改情况对比说明等相关文件。
办理说明书更改告知需满足以下条件:
已注册医疗器械的说明书
除注册证及其附件载明事项之外的其他内容发生变化
不属于变更注册范围内的
二、三种审查结果
同意
不同意
部分同意
三、医疗器械说明书更改告知办理流程图
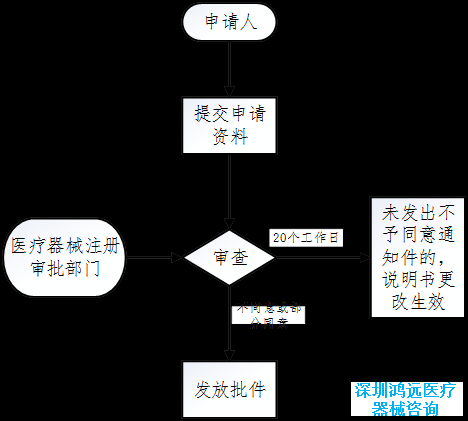
线上途径(eRPS系统):行政相对人通过eRPS系统提交说明书更改告知申请及相关资料。
线下途径改:符合条件的行政相对人应按照《关于发布医疗器械注册证补办程序等5个相关工作程序的通告》的相关要求准备资料。四、TIPS
进入国家药品监督管理局"政务服务门户"版块,可查看批件发布信息。
规定时限内未答复的视为同意。
深圳鸿远医疗器械咨询, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(陕西、四川、重庆、成都、武汉、湖北、郑州、山东、山西,江苏、浙江)等地区的医疗器械生产、销售企业提供技术咨询服务。鸿远医疗器械咨询专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、医疗器械说明书变更申请代办,代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服