
医疗器械注册代办咨询据国家药监局器审中心2024年3月18日关于发布医疗器械分类目录相关产品临床评价推荐路径(2024年增补)的通告(2024年第11号)具体内容如下:

为进一步指导注册医疗器械申请人确定具体产品的临床评价路径,器审中心在2022年已发布《关于发布<医疗器械分类目录>子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号)》《关于发布<医疗器械分类目录>子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号)》《关于发布<医疗器械分类目录>子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号)》的基础上,基于最新的产品研发和申报情况、临床评价监管科学研究成果和技术审评工作实践,增补新一批具体产品临床评价的推荐路径。
附件:
1.《医疗器械分类目录》相关产品临床评价推荐路径(2024年增补)使用说明
2022年,基于《医疗器械分类目录》22个子目录的产品描述、预期用途和品名举例,器审中心制定并发布《<医疗器械分类目录>相关产品临床评价推荐路径》,包括《关于发布<医疗器械分类目录>子目录11、12、13、14、15、17、22相关产品临床评价推荐路径的通告(2022年第20号)》《关于发布<医疗器械分类目录>子目录02、03、05、06、16、18、20相关产品临床评价推荐路径的通告(2022年第24号)》《关于发布<医疗器械分类目录>子目录01、04、07、08、09、10、19、21相关产品临床评价推荐路径的通告(2022年第30号)》等三份文件,给出具体产品推荐的临床评价路径。
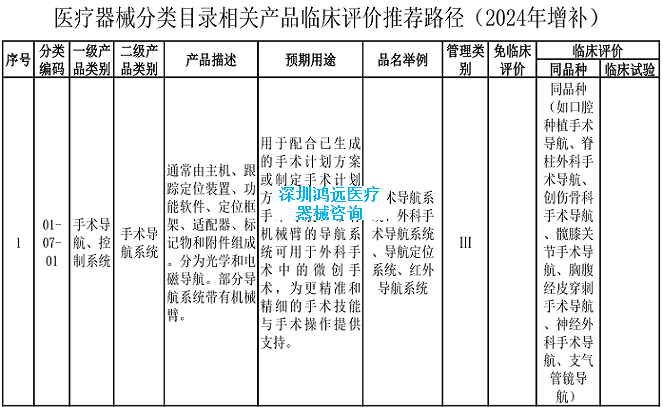
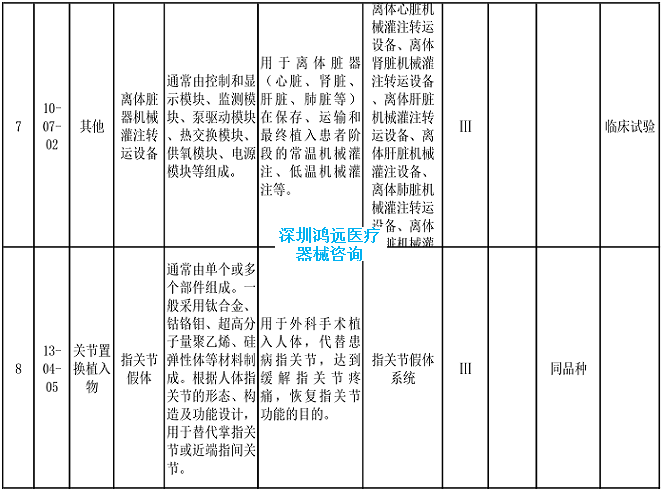
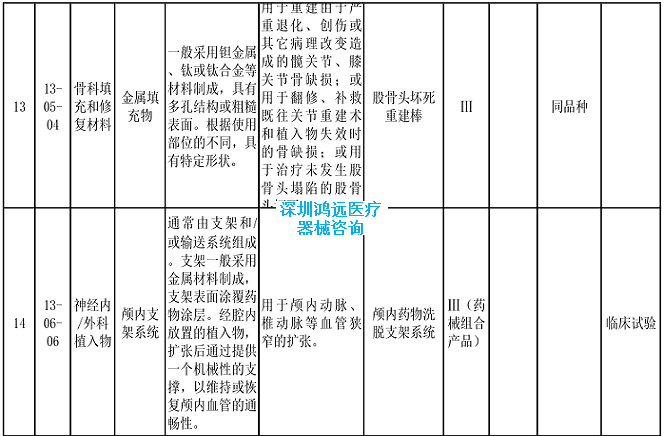
2024年,基于最新的产品研发和申报情况、临床评价监管科学研究成果和技术审评工作实践,进一步明确了手术导航系统、离体脏器机械灌注转运设备、整形用植入线材等产品的临床评价推荐路径。
文件中标注“临床试验”的产品,基于目前认知,通常为《决策是否开展医疗器械临床试验技术指导原则》(2021年第73号,以下简称“《决策导则》”)中的“高风险医疗器械”,除该指导原则第三部分第(一)款中可考虑免于开展临床试验的情形,原则上需要开展临床试验。
文件中标注“同品种”的产品,如申报产品与同品种医疗器械相比,适用范围、技术特征和/或生物学特性等方面具有显著差异,属于《决策导则》中提出的“新型医疗器械”,除《决策导则》第三部分第(二)款中可考虑免于开展临床试验的情形,需提交申报产品的临床试验资料。
文件中标注“同品种”的产品,如不属于《决策导则》中提出的“新型医疗器械”,申请人可按照《医疗器械临床评价技术指导原则》《医疗器械临床评价等同性论证技术指导原则》《医疗器械注册申报临床评价报告技术指导原则》(2021年第73号)的相关要求,根据申报产品特征、临床风险、已有临床数据等情形,选取合适的同品种医疗器械,通过对同品种医疗器械临床数据进行分析评价,证明医疗器械的安全性、有效性。此种情形下,如通过非临床研究未能证明差异性部分的安全有效性,即《决策导则》中提出的“已有证据不能证明产品符合医疗器械安全和性能基本原则”。
器审中心将根据医疗器械风险变化,参考国际经验,遵循最新科学认知,立足监管实际,对相关产品的临床评价推荐路径进行动态调整。
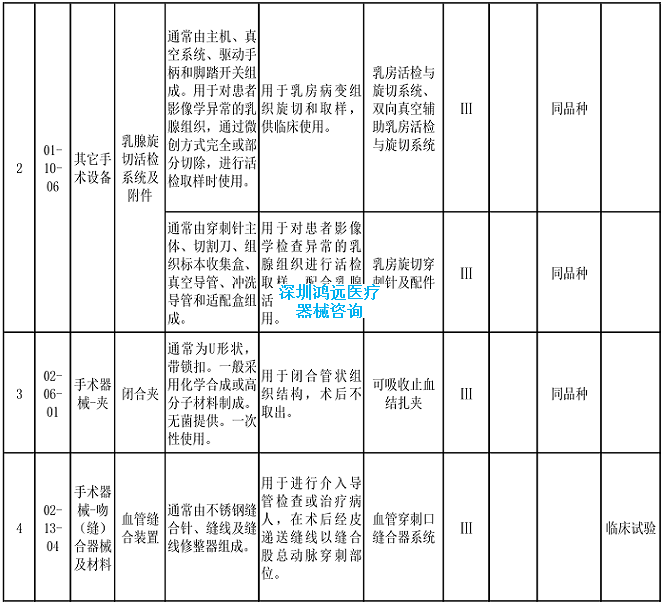
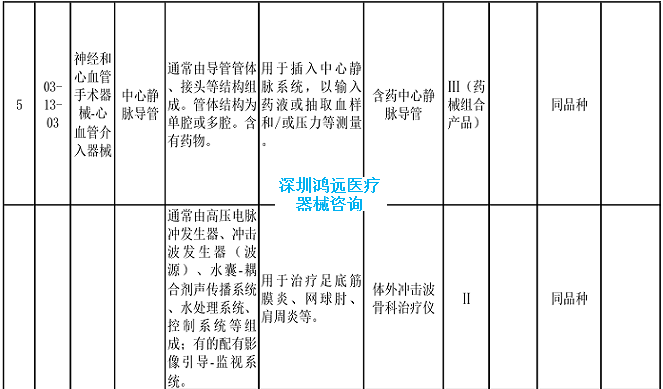
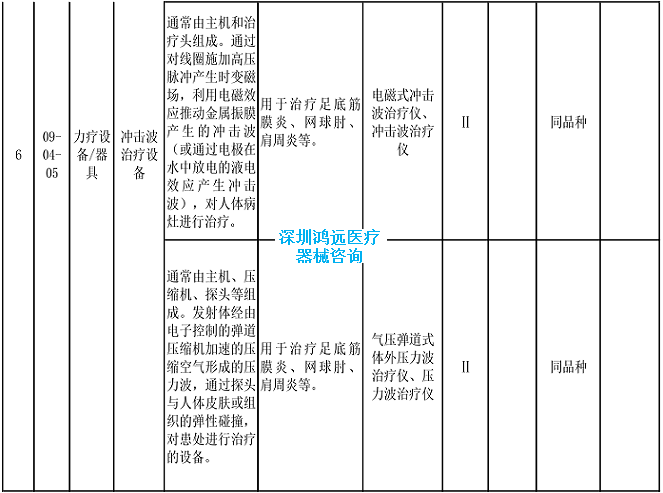
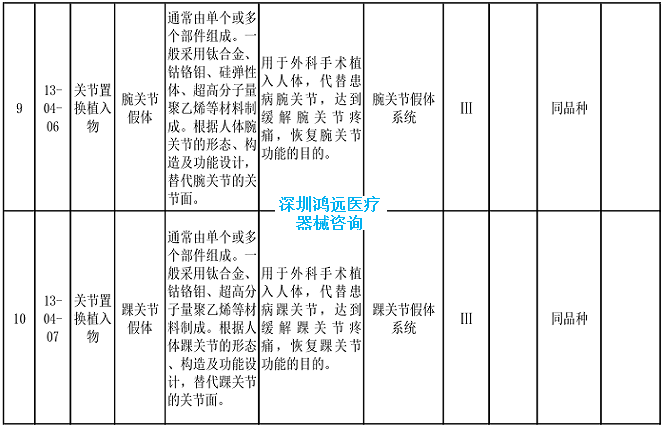
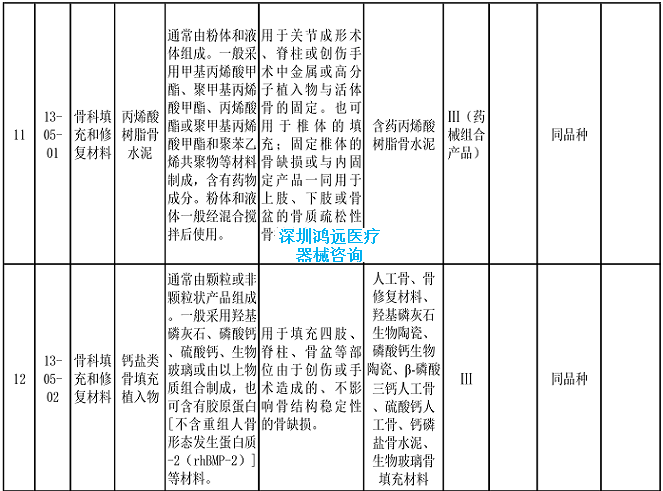
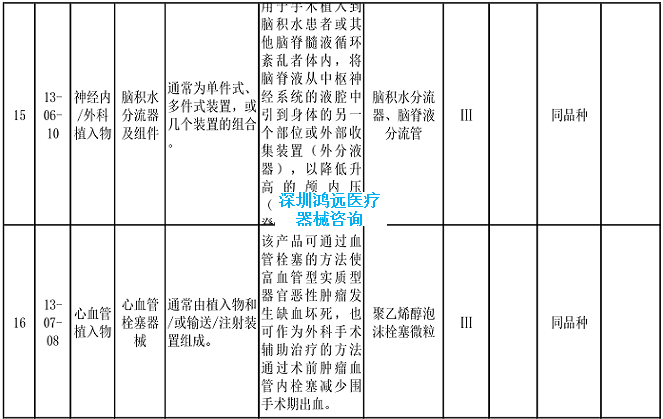
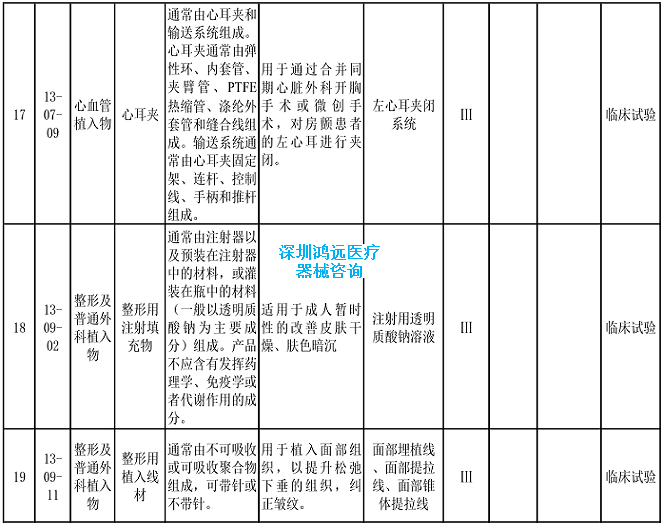
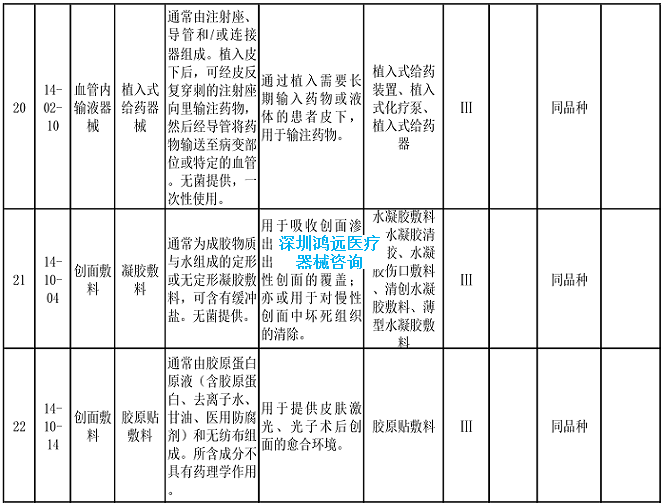
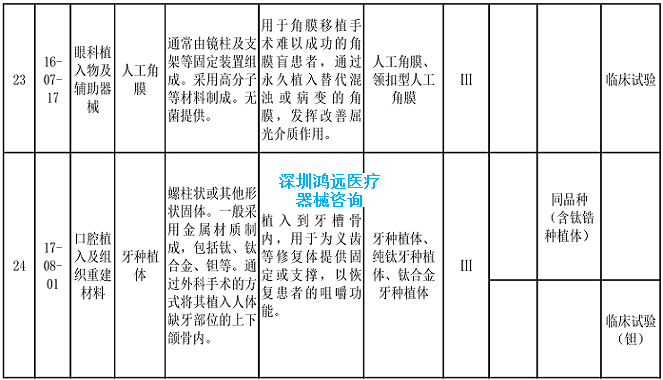
2.《医疗器械分类目录》相关产品临床评价推荐路径(2024年增补)

深圳鸿远医疗器械咨询, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(陕西、四川、重庆、成都、武汉、湖北、郑州、山东、山西,江苏、浙江)等地区的医疗器械生产、销售企业提供技术咨询服务。鸿远医疗器械咨询专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服