
医疗器械咨询 据FDA“开发新工具、新标准、新方法以研究FDA 所监管产品的安全性、有效性、产品质量、毒性、性能以及对公众健康影响的科学”是美国食品药品监督管理局(FDA)对“监管科学”的定义。近些年,FDA致力于深入研究能为公众健康带来价值的新工具和新方法。计算机建模和仿真作为一种在保证产品安全有效前提下加速产品上市、减轻行政相对人临床试验负担的新工具和新方法正在被FDA持续关注、研究并逐渐开始广泛应用。2018年, FDA公布的战略政策路线图(FDA’s 2018 Strategic Policy Roadmap)中有多项工作与计算机建模和仿真方法相关。FDA下属器械和放射健康中心(以下简称CDRH)在2017年发布的十大监管科学优先事项中,一项重要内容就是 “发展计算机建模技术作为法规决策支持的重要工具”。
FDA已建立计算机建模和仿真研究工作组,对该方法在监管科学中的应用进行深入研究。下面介绍工作组具体情况及该方法在FDA的应用。
一、计算机建模和仿真工作组
FDA由5个办公室承担主要工作职能,分别为食品及兽药监管办公室、全球监管运营及政策办公室、医疗产品及烟草监管办公室、运营办公室和政策、规划、立法及分析办公室。还包括7个专员办公室,分别为首席科学家办公室、妇女卫生办公室、少数族裔卫生办公室、执行秘书处办公室、局长顾问办公室、实验室科学与安全办公室、对外事务办公室,共计12个办公室组成。其中,首席科学家办公室的主要职能包括促进开发和使用创新技术;支持FDA科学家在各领域的专业发展;为科学的活动提供战略领导和支持,推动监管科学并解决有关FDA监管产品的重要公共卫生问题等。该办公室支持了建模和仿真、增材制造、纳米技术、新兴科学、生物标记、标准研究、动物福利、毒理学研究、基因组学研究、微生物组学研究、社会行为学等十余个工作组的研究工作。
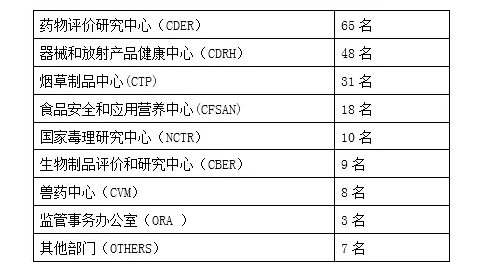
计算机建模和仿真工作组为跨部门工作组。近两百名专家参与到该工作组中,人员分布在各中心,其中药物评价研究中心(CDER)、器械和放射产品健康中心(CDRH)的专家人员最多,分别为65名和48名,详见下表1。目前,工作组的两位主席分别由CDRH的两位专家担任。工作组有如下5项主要任务:提升计算机模拟和仿真方法的认识,推动监管科学的发展;加强各方对该方法的交流;作为FDA在该领域及其他新兴领域的科学支撑;与开展同样工作的国内和国际组织进行合作;促进该方法的审评一致性及相应的决策支持。
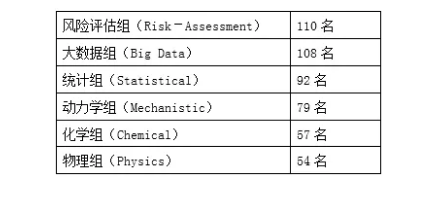
工作组又组建若干个兴趣组,涉及物理(Physics)、化学(Chemical)、大数据(Big Data)、动力学(Mechanistic)、风险评估(Risk Assessment)和统计(Statistical),详见下表2。每个兴趣组均有2-3名组长负责组内工作。另外建立执行机构,负责整个工作组的各项具体工作。
执行机构主要负责:
1、制定交流计划:负责统筹内部机构间及与外部相关机构的交流;
2、发布FDA建模和仿真领域的白皮书:其中会涉及各机构的成功案例,通过解决难题促进建模方法更广泛的应用,以及与内外部相关机构研究该方法的新的机遇;
3、研究仿真控制和可信度准则方面的工作:通过美国机械工程师协会在制定标准过程中参与与相关基础性研究工作。
该工作组前期已与国内和国际组织开展多次交流和合作,包括加入美国国立卫生研究(NIH)发起的建模和分析组织;与欧盟相应机构于2017年展开交流,提升双方对计算机建模和仿真的认识,并达成初步共识。
二、计算机建模和仿真新方法在FDA监管科学中的应用
计算机建模和仿真新方法在FDA战略计划中发挥着非常重要的作用,目前已有多领域利用该方法进行了应用,如通过定量结构活性关系模型((Q)SAR模型)预测化学药物的风险;通过建立细胞、组织和系统的计算机模型较好的预测医疗产品的安全有效性;通过建立虚拟病人模型用于测试医疗产品;通过计算机模型模拟临床试验方法显示治疗效果、患者特性及疾病变量的内部关系;作为知识构建工具用于数据挖掘、可视化研究、高通量方法(蛋白结构学)方面的研究等等。
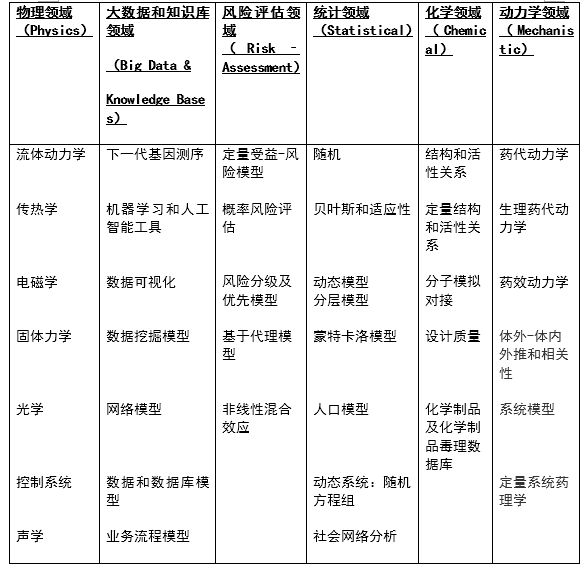
计算机建模和建模新方法已在物理、大数据、风险评估、统计、化学和动力学等多个领域有所应用(详见下表3)。虽然目前FDA用于评价产品安全有效性的主要方法仍然为实验室模型、动物模型和临床数据,且计算机模型和仿真新方法的比例与其他方法相比仍然不高,但FDA预测,该方法配合虚拟病人的应用会快速发展,未来将成为评价医疗产品的主要方法。
医疗器械FDA注册参考文献:
[1] 刘文博.医疗器械审评科学——Regulatory Science 在医疗器械技术审评工作中的应用发展. [EB/OL]. 2018-02-09.https://www.cmde.org.cn/CL0033/7053.html
[2] 美国FDA. Healthy Innovation, Safer Families: FDA's 2018 Strategic Policy Roadmap [EB/OL]. 2018-01-11.https://www.fda.gov/about-fda/reports/healthy-innovation-safer-families-fdas-2018-strategic-policy-roadmap
[3] 美国FDA. Organization Charts. [EB/OL]. 2018-08-30.https://www.fda.gov/AboutFDA/CentersOffices/OrganizationCharts/ucm393155.htm
深圳鸿远医疗器械咨询服务公司 是一家技术专业的医疗器械咨询服务公司,专注提供全国各地如:深圳、广州、东莞、中山、佛山、潮州、顺德、上海、西安、重庆、成都、安徽、江苏、浙江等知名城市的医疗器械领域技术咨询服务。深圳鸿远医疗器械咨询专业服务于:医疗器械产品注册证代办理咨询、医疗器械产品分类界定代办理,代办医疗器械生产许可证、一类医疗器械产品备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服