
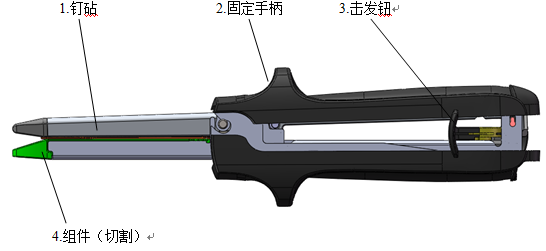
吻(缝)合器
医疗器械注册吻(缝)合器产品的主要技术指标:本条款给出吻合器需要考虑的基本技术性能指标,其中对产品的技术要求主要参照YY/T 0245-2008《吻(缝)合器通用技术条件》。此外企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的要求。以下如有不适用条款(包括国家标准、行业标准要求),企业在注册产品标准的编制说明中必须说明理由。
1.医疗器械注册吻(缝)合器产品外观要求
(1)吻合器外表光滑、无锋棱、毛刺及裂纹,器身上的刻度值或标识应清晰。
(2)吻合器壳体的粘合(或焊接)应牢固,不得有裂缝和明显堆积物。
(3)吻合钉钉头应尖锐,表面不得有凹痕、划伤等缺陷;切割刀应锋利,不得有卷刃、崩刃。
2.医疗器械注册吻(缝)合器产品尺寸要求
吻合器的尺寸应符合注册产品标准中的规定。
3.医疗器械注册吻(缝)合器产品材料要求
应明确参照YY/T 0245-2008《吻(缝)合器通用技术条件》或相关国家标准、行业标准要求写出吻合器的全部制作材料及其材料标准(包括吻合钉)。
4.医疗器械注册吻(缝)合器产品使用性能要求
(1)吻合器的组件与器身架应能顺利地装配和拆卸;各移动部位应能顺利推动,不得有卡住、松动现象;组件装入器身应牢固,吻合钉不得脱落变形。
(2)吻合器的保障机构(释放钮、关闭柄)开闭应灵活,使用应安全。弹簧应有足够弹性,当松开手柄时能迅速复位。
(3)吻合钉头端应尖锐;切割刀应锋利,不得有卷刃、崩刃。
5.医疗器械注册吻(缝)合器产品硬度要求
采用20Cr13材料制成的部件应经热处理,其硬度为40HRC-48HRC;切割刀的硬度应不低于377HV0.2。(制造商也可根据自己产品的性能制定部件和切割刀的硬度,但是需要提供完整的验证资料予以证明)。
6.表面粗糙度:吻合器外露金属表面粗糙度Ra≤0.8μm。
7.耐腐蚀性能:重复性使用吻合器切割刀、抵钉座的耐腐蚀性能应符合YY/T0149中5.4 b级的规定
8.一次性吻合器包装封口剥离强度:吻合器封口剥离强度应在0.1-0. 5(N/mm)范围内,被撕开的两接触表面应光滑且连续均匀无分层或撕裂现象。
9.灭菌:一次性使用吻合器及组件经已确认过的灭菌过程进行灭菌。
10.环氧乙烷残留量:如采用环氧乙烷灭菌,一次性使用吻合器及组件的环氧乙烷残留量应不大于10 μg/g。
11.生物学评价
(1)表面作改性处理(包括表面涂层、酸蚀及其他表面处理)的纯钛、钛合金材料和纯钽材料制成的吻合钉的生物学评价应符合GB/T 16886.1的规定。
(2)吻合器及组件的细胞毒性应不大于1级。
(3)吻合器及组件迟发型超敏反应的等级应不大于1。
(4)吻合器及组件皮内反应的计分应不大于1。
12.吻合口的耐压要求
经吻合器缝合后的缝合口应能承受不小于3.6kPa的压力,不得有漏水和撕裂现象
13.医疗器械注册吻(缝)合器产品吻合器附件(若有)要求:应分别列出附件的材料、尺寸、性能要求;此外根据不同材料特性,由企业决定是否对吻合器及组件的化学性能提出要求。
深圳鸿远医疗器械咨询专注于医疗器械注册,医疗器械注册咨询代理,医疗器械生产许可证,医疗器械经营许可证,进口医疗器械注册,医疗器械备案,计量生产许可证办理,FDA注册,ISO13485认证CE认证,临床试验,医疗器械分类,洁净室设计指导,医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册,出口证,自由销售证办理,产品检测,临床试验及免临床资料编写,产品技术要求制订,技术文件编写辅导等.

 在线客服
在线客服