
医疗器械产品注册申报电子上消化道内窥镜产品(不包括电子十二指肠内窥镜),分类编码为06-14-03,其他软性电子内窥镜可参考该指导原则中适用的内容。
电子上消化道内窥镜产品产品名称要求
医疗器械注册电子上消化道内窥镜产品的命名应符合《医疗器械通用名称命名规则》。产品名称一般由一个核心词和不超过三个特征词组成,电子上消化道内窥镜产品名称通常包括“电子”和“观察部位”,观察部位如上消化道、胃、十二指肠,产品名称应根据产品适用范围确定,可命名为电子上消化道内窥镜、电子上消化道内镜、上消化道电子内窥镜、上消化道电子内镜。
电子上消化道内窥镜产品适用范围:
电子上消化道内窥镜一般在医院内镜室使用,通过口腔或鼻腔进入人体消化道,对预期区域或部位进行照明并于体外成像以供观察和诊断,结合手术器械可进行内镜手术和治疗。适用范围通常描述为“与电子内窥镜图像处理装置(型号***)配合使用,用于通过视频监视器提供影像供上消化道(也可描述为食道、胃等解剖结构,但通常不包括十二指肠)的观察、诊断和治疗”。配合使用的图像处理装置的规格型号应与配合进行电磁兼容的规格型号一致。如内窥镜不包括工作通道,则不能用于手术或取活检等操作,适用范围描述为“与***型号的电子内窥镜图像处理装置(型号***)配合使用,用于通过视频监视器提供影像供上消化道(也可描述为食道、胃等解剖结构,但通常不包括十二指肠)的观察、诊断”。配合使用的内窥镜图像处理装置可集成内窥镜冷光源。
医疗器械注册办理电子上消化道内窥镜产品结构和组成:
电子上消化道内窥镜为软性电子内窥镜,一般为直视型(视向角为0度),镜体由头端部、弯曲部、插入部(也称作主软管)、操作部及连接部组成,产品组成中可包括与之连接、组装的附件,例如吸引按钮、送气/送水按钮等。使用前,将按钮安装到电子上消化道内窥镜上,通过连接部插头将内窥镜与内窥镜冷光源及图像处理装置连接。
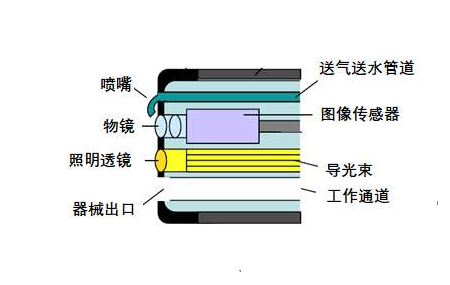
1.头端部
头端部为内窥镜中最为精密的部分,是实现内窥镜诊断和治疗的重要组成部分。其中内置了图像传感器、物镜、照明透镜、冲刷物镜表面的送气送水喷嘴等基本部件。根据功能不同,可增加器械孔道、副送水管道等。图像传感器是内窥镜成像的核心部分,在一定程度上影响内窥镜图像的优劣,目前常用的图像传感器有CCD和CMOS两种。
2.弯曲部
弯曲部一般由可四向弯曲的蛇管实现弯曲功能,外部包覆氟橡胶、氟树脂等外皮,通过操作部角度控制旋钮驱动内窥镜内部链条和钢丝,带动弯曲部蛇管上下、左右弯曲,可易于插入体内并且进行目标部位的观察,弯曲部结构示意图
医疗器械产品注册办理电子上消化道内窥镜产品产品技术要求:
医疗器械注册代办申请人应按照《医疗器械产品技术要求编写指导原则》编写产品技术要求,通常应包括光学性能、机械性能、化学性能、电气安全、电磁兼容等指标。光学性能包括视场角、中心角分辨力(参考YY0068.1的4.3.1.1)和边缘角分辨力(参考YY0068.1中4.5.2.1中边缘的界定为Wp的90%视场处)、景深、畸变、色彩还原性、照明镜体光效、亮度响应特性、信噪比、空间频率响应、静态图像宽容度等;机械性能包括尺寸、外观、操控性能、吸引和送气送水性能、弯曲性能、密封性能、与附件配合的性能等,化学性能主要包括插入部分表面聚合物材料的溶解析出物的要求,电气安全包括GB9706.1和GB9706.19,电磁兼容包括YY0505的要求。同时产品技术要求中应给出产品结构示意图和与患者接触部分的材料。
本条款给出需要考虑的产品基本技术性能指标,但并未给出定量要求,医疗器械产品注册代办申请人可参考相应的国家标准、行业标准,根据申请人自身产品的技术特点制定相应的要求。产品技术要求中性能指标可参考的标准包括YY 1028、YY/T 1587。如有适用的新版国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
医疗器械注册单元划分根据《医疗器械注册管理办法》第七十四条规定,医疗器械注册单元原则上以产品的技术原理、结构组成、性能指标和适用范围为划分依据。参考《医疗器械注册单元划分指导原则》,结合电子内窥镜产品技术特点,注册单元划分建议符合以下原则:
(一)适用范围不同的内窥镜应划分为不同的注册单元,例如电子上消化道内窥镜与电子十二指肠内窥镜、电子上消化道内窥镜与电子下消化道内窥镜。
(二)技术原理不同的内窥镜应划分为不同的注册单元。例如纤维上消化道内窥镜与电子上消化道内窥镜。
(三)结构组成不同的内窥镜应划分为不同的注册单元,例如超声电子上消化道内窥镜与电子上消化道内窥镜、图像传感器为CCD的内窥镜与图像传感器为CMOS的内窥镜。
(四)内窥镜与配合使用的主机(内窥镜冷光源、图像处理装置等)应划分为不同的注册单元。
(五)内窥镜与配合使用的手术器械(高频手术器械、激光光纤)等应划分为不同的注册单元。
(六)可重复使用的内窥镜与一次性使用的内窥镜通常应划分为不同的注册单元。
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(西安、四川、重庆、成都、武汉、湖北、郑州、山东、山西,江苏、浙江)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服