
医疗器械人工复苏器产品注册适用的相关标准
医疗器械注册 人工复苏器,该产品用于实施人工呼吸、急救时提供肺通气。根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017第104号),人工复苏器的管理类别为二类,分类编码为080305(呼吸、麻醉和急救器械急救设备人工复苏器(人工复苏器))。 产品名
医疗器械注册人工复苏器,该产品用于实施人工呼吸、急救时提供肺通气。根据《医疗器械分类目录》(国家食品药品监督管理总局公告2017第104号),人工复苏器的管理类别为二类,分类编码为08—03—05(呼吸、麻醉和急救器械—急救设备—人工复苏器(人工复苏器))。
产品名称要求
人工复苏器产品命名应符合《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)、《医疗器械分类目录》和行业标准中的通用名称,如“人工复苏器”、“简易呼吸器”。
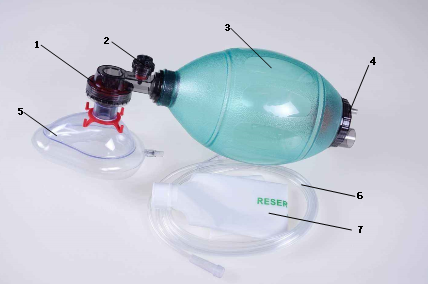
产品的结构和组成
人工复苏器通常由病人阀(可含限压阀)、呼吸球囊、进气阀组组成。可根据不同的使用要求配置各种相应的选配件,如面罩、氧气管、储气袋或储气管等。按照使用次数可以分为可重复使用、一次性使用产品。产品结构示意图如下:
1-病人阀 ; 2-限压阀; 3-呼吸球囊; 4-进气阀组;
5-面罩(选配); 6-氧气管(选配); 7-储气袋(选配)
图1 人工复苏器示意图
人工复苏器产品主要用于实施人工呼吸、急救时提供肺通气。使用时,按压呼吸球囊,进气阀组关闭,气体经病人阀端进入患者呼吸道;释放呼吸球囊,病人阀关闭,在压力差作用下,外界空气经进气阀组进入球囊。当需要高浓度氧气输送时,复苏器连接氧气管、储气袋或储气管使用,通过氧气管接头连接氧气源,储气袋充满氧气后,过量氧气通过进气阀组排出到空气中。
医疗器械产品注册人工复苏器适用的相关标准
如表1列出人工复苏器主要涉及的现行有效的国家/行业标准、国际标准;如有标准发布或更新,应当考虑新版标准的适用性。
表1 产品适用标准(统一格式,标准编号)
| 标准编号 | 标准名称 |
|---|---|
| GB/T 191—2008 | 包装储运图示标志 |
| GB 18280.1-2015 | 医疗保健产品灭菌 辐射 第1部分:医疗器械灭菌过程的开发、确认和常规控制要求 |
| GB 18280.2-2015 | 医疗保健产品灭菌 辐射 第2部分:建立灭菌剂量 |
| GB/T 18280.3—2015 | 医疗保健产品灭菌 辐射 第3部分:剂量测量指南 |
| GB 18279.1-2015 | 医疗保健产品灭菌 环氧乙烷 第1部分:医疗器械灭菌过程的开发、确认和常规控制的要求 |
| GB/T 18279.2-2015 | 医疗保健产品的灭菌 环氧乙烷 第2部分:GB 18279.1应用指南 |
| GB/T 19633.1-2015 | 最终灭菌医疗器械包装 第1部分:材料、无菌屏障系统和包装系统的要求 |
| GB/T 19633.2-2015 |
最终灭菌医疗器械包装 第2部分:成形、密封和装配过程的确认的要求 |
| GB/T 14233.1—2008 | 医用输液、输血、注射器具检验方法第1部分:化学分析方法 |
| GB/T 14233.2-2005 | 医用输液、输血、注射器具检验方法第2部分:生物学试验方法 |
| GB/T 16886.1—2011 | 医疗器械生物学评价 第1部分:风险管理过程中的评价与试验 |
| GB/T 16886.5—2017 | 医疗器械生物学评价 第5部分:体外细胞毒性试验 |
| GB/T 16886.7-2015 | 医疗器械生物学评价 第7部分:环氧乙烷灭菌残留量 |
| GB/T 16886.10—2017 | 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
| GB/T 16886.12-2017 | 医疗器械生物学评价 第12部分:样品制备与参照样品 |
| YY/T 0287—2017 | 医疗器械质量管理体系用于法规的要求 |
| YY/T 0313—2014 | 医用高分子产品包装和制造商提供信息的要求 |
| YY/T 0316—2016 | 医疗器械风险管理对医疗器械的应用 |
| YY/T 0466.1—2016 | 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求 |
| YY/T 1474—2016 | 医疗器械可用性工程对医疗器械的应用 |
| YY 0600.4-2013 | 医用呼吸机 基本安全和主要性能专用要求 第4部分:人工复苏器 |
| YY/T 1040.1-2015 | 麻醉和呼吸设备 圆锥接头 第1部分:锥头与锥套 |
| GB/T 1962.1-2015 | 注射器、注射针及其他医疗器械用6%(鲁尔)圆锥接头 第1部分:通用要求 |
| ISO 18562-1:2017 | Biocompatibility evaluation of breathing gas pathways in healthcare applications -- Part 1: Evaluation and testing within a risk management process |
| / | 中华人民共和国药典(2015版) |
上述标准包括了产品研发及医疗器械注册申报资料中经常涉及的标准。不包括根据产品的特点所引用的一些行业外标准或其他标准。
西安医疗器械注册咨询,产品适用及引用标准的审查可以分两步来进行。首先对引用标准的齐全性和适宜性进行审查,也就是审查产品技术要求中与产品相关的国家标准、行业标准是否进行了引用,以及引用是否准确。应注意引用标准的编号、名称是否完整规范,年代号是否有效。其次对引用标准的采纳情况进行审查。即所引用的标准中的条款要求,是否在产品技术要求中进行了实质性的条款引用。这种引用通常采用两种方式,文字表述繁多内容复杂的可以直接引用标准及条文号,比较简单的也可以直接引述具体要求。
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(西安、汉中、武汉、重庆、成都)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服