
医疗器械注册母亲胎儿多参数监护仪管理类别为二类的母亲胎儿监护仪,分类编码为18-02-01。本标准仅适用于采用体外超声多普勒原理监测胎心率、采用压力传感器监测宫缩数据的监护仪,不包括胎儿体表心电、胎儿直接头皮心电、子宫肌电(宫缩)等。
如果母亲胎儿监护仪作为一个系统中的一部分,则本标准也适用于该部分。
本标准不适用于超声多普勒胎儿心率仪,该类仪器采用的行业标准为YY 0448—2009《超声多普勒胎儿心率仪》。
医疗器械母亲胎儿多参数监护仪产品注册证技术审查要点
(一)产品名称要求
医疗器械产品注册产品的命名应参考《医疗器械通用名称命名规则》(国家食品药品监督管理总局令第19号)和国家标准、行业标准上的通用名称要求。产品名称应以体现产品的工作原理、技术结构特征、功能属性为基本准则,如母亲胎儿多参数监护仪、母亲胎儿监护仪、母胎监护仪、母亲胎儿综合监护仪、母胎监护系统等,不宜采用病症命名。
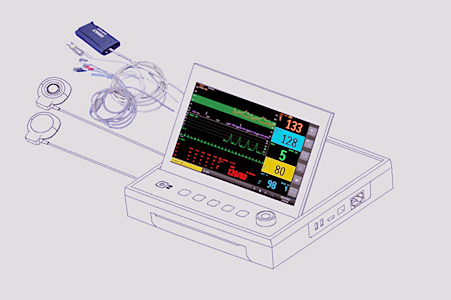
(二)产品的结构和组成
一般由主机及附件(可选配多种附件)组成。一般的结构示意框图如下:
有些设备配有内置打印机的同时,还配有外部打印机或外部打印机接口;显示器也有类似情况。
(三)办理医疗器械注册产品工作原理
母亲胎儿监护仪通常包含多个生理监护单元,可对孕妇同时进行多个生理参数的监测,一般采用超声多普勒原理监测胎儿胎心率,采用压力传感器监测孕妇宫缩压力,通过孕妇自主按压胎动按钮监测胎动。常见的工作原理如下:
1.超声探头原理
胎心多普勒信号检测部分依据超声多普勒频移原理。
超声多普勒的基本原理如下:当声源以固定频率发出声波信号并在器官内传播时,遇到界面将发生反射现象,如果界面相对声源运动,则反射声波频率与入射声波频率有所不同:当界面朝向声源运动时,反射声波频率增加;当界面背离声源运动时,反射声波频率降低,这种现象称为超声波的多普勒效应。多普勒效应发生时,接收到的声波频率和发出声波的频率之间存在一个差值,称为多普勒频移,以 表示
式中 为超声波的频率,C为超声波在器官内的传播速度,V为界面的运动速度。
办理医疗器械产品注册对胎儿心脏采用1MHz的超声波做声源时,对应的频移 为60~400Hz左右。对接收到的超声信号先解调、放大,然后滤波(滤波器的通带频率设定为60~400Hz),这样得到的就是胎心多普勒频移信号,为了计算的方便,再对这个信号进行解包络处理。对AD采样结果进行自相关运算,便能计算出胎心率。
2.手动胎动信号检测原理
通过孕妇在感觉胎动时手动按压胎动按钮,记录胎动信号。
3.宫缩压力探头检测原理
压力检测部分将压力信号转换成电压信号来测量。压力应变片受力变形引起阻值变化。在电路上施加电压,精准测量电阻的变化量,然后由电阻变化量与固体形变之间的关系计算出物体的形变量及所受压力。
4.母亲心电、无创血压、血氧、体温、呼吸等工作原理
常见的母亲生理参数监测工作原理和常规监护仪的生理参数监测工作原理一致,可查阅相关国家药品监督管理局医疗器械技术审评中心发布的指导原则。
母亲胎儿监护仪可实时连续监护母亲的心电、无创血压、脉搏、血氧饱和度、体温、呼吸、宫缩压力以及胎儿胎心率、胎动等变化情况,为临床提供监护数据,它既可单独使用,也可通过网络接口与产科中央监护系统连接,形成网络监护系统,也可以同时提供多种移动应用解决方案。
检测胎儿心率信号经处理后将胎儿心率变化趋势用轨迹描记出来,并能同时描记母体的宫缩曲线。医生根据这二条曲线的变化趋势可以初步判断胎儿的健康状态,以便及时采取措施。
母亲胎儿监护仪所使用的超声波生物物理特性主要有机械效应、热效应和空化效应。具体产品可能涉及以上全部或部分效应。但其强度一般很低。
母亲胎儿监护仪作为非治疗设备,其设备向人体传送能量和从人体取得能量以获取所需信息。该产品用于监护,不以治疗为目的。
(四)医疗器械注册证单元划分的原则和实例
母亲胎儿监护仪的注册单元划分应以《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)为依据,一般以主要技术结构、设备配置、性能指标为划分条件。如:
1.不同的技术结构产品设备配置应作为不同的注册单元进行注册。
2.胎儿监护仪与母亲胎儿监护仪建议划分为不同的注册单元。
目前与产品相关的常用医疗器械注册标准举例如下:
| 标准编号 | 标准名称 |
| GB 9706.1—2007 | 医用电气设备 第1部分:安全通用要求 |
| GB 9706.9—2008 | 医用电气设备 第2-37部分:医用超声诊断和监护设备安全专用要求 |
| GB 9706.15—2008 | 医用电气设备 第1-1部分:安全通用要求并列标准:医用电气系统安全要求 |
| GB 9706.25—2005 | 医用电气设备 第2-27部分:心电监护设备安全专用要求 |
| GB/T 14710—2009 | 医用电器环境要求及试验方法 |
| GB/T 16846—2008 | 医用超声诊断设备声输出公布要求 |
| GB/T 16886.1—2011 | 医疗器械生物学评价第1部分:评价与试验 |
| GB/T 16886.5—2017 | 医疗器械生物学评价 第5部分:体外细胞毒性试验 |
| GB/T 16886.10—2017 | 医疗器械生物学评价 第10部分:刺激与迟发型超敏反应试验 |
| GB/T 16886.12—2017 | 医疗器械生物学评价 第12部分:样品制备与参照样品 |
| GB/T 21417.1—2008 | 医用红外体温计 第1部分:耳腔式 |
| YY/T 0196—2005 | 一次性使用心电电极 |
| YY/T 0449—2018 | 超声多普勒胎儿监护仪 |
| YY 0505—2012 | 医用电气设备第1-2部分:安全通用要求并列标准:电磁兼容要求和试验 |
| YY/T 0664—2008 | 医疗器械软件 软件生存周期过程 |
| YY 0667—2008 | 医用电气设备 第2-30部分:自动循环无创血压监护设备安全和基本性能专用要求 |
| YY 0668—2008 | 医用电气设备 第2-49部分:多参数患者监护设备安全专用要求 |
| YY 0670—2008 | 无创自动测量血压计 |
| YY/T 0708—2009 | 医用电气设备 第1-4部分:安全通用要求 并列标准:可编程医用电气系统 |
| YY 0709—2009 | 医用电气设备 第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南 |
| YY 0784—2010 | 医用电气设备 医用脉搏血氧仪设备基本安全和主要性能专用要求 |
| YY 0785—2010 | 临床体温计 连续测量的电子体温计性能要求 |
| YY 0828—2011 | 心电监护仪电缆和导联线 |
| YY 1079—2008 | 心电监护仪 |
| YY/T 1142—2013 | 超声诊断和监护仪器频率特性的测试方法 |
| YY/T 1474—2016 | 医疗器械 可用性工程对医疗器械的应用 |
如有新版强制性国家标准、行业标准发布实施,产品性能指标等要求应执行最新版本的国家标准、行业标准。
(六)产品的适用范围/预期用途、禁忌证
1.适用范围
供母亲的心电、无创血压、脉搏、血氧饱和度、体温、呼吸、宫缩压力以及胎儿胎心率、胎动监测用。(按产品配置的功能进行确认)
2.禁忌证
包括但不限于以下禁忌证:
(1)在除颤、电外科手术或磁共振成像(MRI)期间使用。
(2)对已连接电刺激器或心脏起搏器的孕妇进行心电图测量。
(3)禁止对患有镰形细胞病或皮肤损伤的患者使用NIBP监测。
(七)代理医疗器械注册产品的主要风险
1.母亲胎儿监护仪的风险管理报告应符合YY/T 0316—2016《医疗器械风险管理对医疗器械的应用》中的相关要求,判断与产品有关的危害估计和评价相关的风险,控制这些风险并监视风险控制的有效性。申请人提供注册产品的风险管理报告应扼要说明:
(1)在拟注册产品的研制阶段,已对其有关可能的危害及产生的风险进行了估计和评价,并有针对性地实施了降低风险的技术和管理方面的措施。
(2)在产品过程测试中部分验证了这些措施的有效性,达到了通用和相应专用标准及技术规范等的要求。
(3)综合剩余风险是可接受的。
(4)已有适当方法获得相关生产和生产后信息。
2.风险管理报告的内容至少包括:
(1)产品的风险管理组织。
(2)产品的组成及预期用途。
(3)风险报告编制的依据。
(4)产品与安全性有关的特征的判定。
医疗器械产品注册证申报方应按照YY/T 0316—2016《医疗器械风险管理对医疗器械的应用》附录C的34条提示,对照产品的实际情况作出针对性的简明描述。
注意:产品如存在34条提示以外的可能影响安全性的特征,也应作出说明。
(5)对产品的可能危害、可预见事件序列和危害处境的判定。
代理医疗器械产品注册申报方应根据自身产品特点,根据YY/T 0316—2016附录E的提示,对危害、可预见事件序列、危害处境及可导致的损害作出判定。表2所列为母亲胎儿监护仪的常见危害:
表2 母亲胎儿监护仪的常见危害
| 编号 | 可预见的事件序列 | 危害处境 | 损害 |
|---|---|---|---|
| 1 | 能量的危害 | ||
| 1.1 | 电能 | ||
| 1.1.1 | 电源输入插头剩余电压 | 插头与网电源分离后,产品内滤波器剩余电压不能快速泄放。 | 导致对孕妇(和/或操作者)电击伤害。 |
| 1.1.2 | 过量的漏电流 | 绝缘/隔离效果不符合要求 | |
| 1.1.3 | 通过应用部分(探头、宫缩传感器)引起孕妇触电 |
1. 隔离措施不足; 2. 电介质强度达不到要求; 3. 声透镜材料磨损、老化龟裂甚至脱落。 |
|
| 1.1.4 | 误接触高压部分 |
1. 安全地线没有或失效; 2. 高压绝缘介质年久老化,绝缘性能下降,导致高压击穿。 |
|
| 1.2 | 热能 | ||
| 1.2.1 | 非预期的或过量的传感器表面温升 | 传感器压电晶片振动的机械耗损、声阻抗匹配不佳引起的损耗和高压开关损耗。 | 引起人体组织过热或导致烫伤。 |
| 1.2.2 | 超声输出声强过高和/或辐照时间过长 | 超声波携带的机械能部分被人体吸收并转为热能。 | |
| 1.3 | 声能 | ||
| 孕妇及胎儿在监测过程中接受的非预期声辐射剂量 |
产品故障或失控,导致过大超声剂量作用于人体; 产品声输出控制、显示功能失效或故障。 |
可能造成人体组织细胞损伤。 | |
| 1.4 | 机械力 | ||
| 1.4.1 | 操作者使传感器与人体皮肤接触时用力过大 | 操作者缺乏相关常识。 | 孕妇腹部压力过大,引起孕妇不适。 |
| 1.4.2 | 锐边或尖角 | 主机或/和治疗头表面有锐边或尖角。 | 使用者和孕妇被划伤。 |
| 1.4.3 | 坠落 | 便携式提拎装置不牢固。 | 使用者和孕妇被砸伤。 |
| 1.4.4 | 坠落 | 设备支撑件强度不足。 | 使用者和孕妇被砸伤。 |
| 1.4.5 | 撞伤 | 带脚轮设备锁定不良。 | 使用者和孕妇被撞伤。 |
| 1.4.6 | 撞伤 | 移动式设备易翻倒。 | 使用者和孕妇被撞伤。 |
| 1.4.7 | 压伤 | 血压袖带、血氧检测探头夹压力不合理。 | 孕妇肌肉压伤。 |
| 2 | 生物学危害 | ||
| 生物不相容性 |
1. 与孕妇接触的传感器材料有致敏性; 2. 与孕妇接触的传感器材料有刺激性; 3. 与孕妇接触的传感器材料有细胞毒性。 |
产生致敏、刺激和细胞毒性反应。 | |
| 3 | 环境危害 | ||
| 3.1 | 设备受到外界的电磁干扰 |
1. 产品设计时抗干扰能力不足; 2. 未考虑电磁环境的影响。 |
不能正常工作。 |
| 3.2 | 设备对外界的电磁辐射干扰 |
1. 屏蔽、滤波及接地技术不完善; 2. 未考虑电磁环境的影响; 3. 产品内部信号线与电源线相互干扰。 |
引起其他设备不能正常工作。 |
| 3.3 | 运输和贮藏 | 不恰当的包装。 | 产品防护不当导致设备运输过程中损坏。 |
| 3.4 | 环境因素 | 过热环境。 | 导致设备不能正常工作。 |
| 3.5 | 环境因素 | 强酸强碱。 | 导致设备不能正常工作。 |
| 3.6 | 环境因素 | 非预期使用于有麻醉剂的环境中。 | 混合气体爆炸。 |
| 3.7 | 环境因素 | 设备的供电电压不稳定。 | 设备不能正常工作或损坏。 |
| 3.8 | 处置和废弃 | 未在使用说明书中对附件的处置和废弃方法进行说明,或信息不充分。 | 环境污染。 |
| 3.9 | 处置和废弃 | 未对设备废弃的处置进行提示性说明。 | 环境污染。 |
| 4 | 器械使用的危害 | ||
| 4.1 | 误操作 |
1. 未经培训的人员使用操作; 2. 使用程序过于复杂或使用说明书表达不当; 3. 对设备及监护电极维护、保养方式、方法、频次进行说明。 4. 未对设备/附件的使用寿命和贮藏寿命进行规定。 |
导致孕妇不适。 设备及各附件不能正常使用。 导致设备/附件超期非正常使用。 导致图像质量等性能指标降低,安全性能出现隐患。 |
| 4.2 | 与消耗品、附件、其他医疗器械的不相容性 | 传感器上用的超声耦合剂不相容。 | 使孕妇皮肤造成不适。 |
| 4.3 | 交叉感染 | 与孕妇接触的部分清洁/消毒不充分或不正确。 | 可导致感染性疾病。 |
| 4.4 | 工作数据的准确性 | 监测数据不准确。 | 导致正确状态误报或危险状态不报。 |
| 4.4 | 不完整的要求 | 参数正常监护范围设计不合理。 | 导致正确状态误报或危险状态不报。 |
| 4.5 | 不完整的要求 | 参数报警设定值设计不合理。 | 导致正确状态误报或危险状态不报。 |
| 4.6 | 不完整的要求 | 报警系统失效。 | 导致正确状态误报或危险状态不报。 |
| 4.7 | 设计缺陷引发可能的使用错误 |
易混淆的或缺少使用说明书: 包括图示符号说明不规范、操作使用方法不清楚、技术说明不清楚、未规定一次性使用电极等消耗性材料采购要求、使用不适用的电极或传感器引起的危险、清洁、消毒灭菌方法不明确、重要的警告性说明或注意事项不明确等。 |
可导致感染性疾病。 |
| 4.8 | 不适当的操作说明 |
血压袖带、血氧检测探头夹压力不合理引起的危险,等等。 使用不当引起的风险: 由缺乏技术的/未经培训的人员使用,不能正确使用和维护保养设备;等等。 未按使用说明书规定使用指定监护电极;等等。 清洁消毒不当引起的危害、使用未经消毒灭菌或不按规定的消毒灭菌方法进行消毒灭菌的器械、一次性使用器械的多次使用、不按制造商推荐的要求采购一次性使用的器械或传感器、不能正常发挥使用性能等。 维护和校正不当,引起的不能正常发挥使用性能。 |
可导致感染性疾病等。 |
| 4.9 | 寿命问题 | 老化、磨损和重复使用而致功能退化。 | 导致设备性能参数指标不符合标准要求。 |
| 5 | 制造过程 | ||
| 5.1 | 制造过程更改的控制不充分 | 控制程序修改未经验证。 | 导致设备性能参数指标不符合标准要求。 |
| 5.2 | 制造过程的控制不充分 | 生产过程关键工序控制点未进行监测。 | 导致部件或整机不合格。 |
| 5.3 | 供方的控制不充分 | 外购、外协件供方选择不当,外购、外协件未进行有效进货检验。 | 导致不合格外购、外协件投入生产。 |
| 6 | 网络安全 | ||
| 6.1 | 设备访问控制不充分 | 未经授权的操作篡改或删除设备的健康数据和设备数据。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 6.2 | 设备数据交换控制不充分 | 设备通过U盘、网络等交换方式交换数据过程中设备的健康数据和设备数据被篡改或丢失。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 6.3 | 设备运行的软件环境不安全 | 设备运行的软件环境存在漏洞,被病毒干扰或黑客攻击导致设备的健康数据和设备数据被篡改或丢失。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 7 | 移动医疗 | ||
| 7.1 | 移动计算终端的数据控制不安全 | 移动终端上的软件保存在终端上的健康数据和设备数据被篡改或丢失。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 7.2 | 移动计算终端的显示屏不足 | 移动终端的显示屏大小、分辨率和亮度不符,导致软件运行在终端上显示的信号、波形等不符合标准要求或无法看清。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 7.3 | 环境光干扰设备 | 环境光太强,移动终端上的软件没有对环境光进行检测,导致血氧检测不准确。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 7.4 | 移动终端电池容量不足 | 移动终端监护过程中,电量不足,导致监护中断。 | 病人误诊或延期治疗。 |
| 7.5 | 云服务使用不当 |
移动终端和云服务器之间数据交互存在漏洞,导致移动终端和云服务器上的健康数据和设备数据被篡改或丢失; 云服务器安全存在漏洞,被黑客或病毒感染导致云服务器上的健康数据和设备数据被篡改或丢失; 云服务器存放环境存在安全风险,导致云服务器上的健康数据和设备数据丢失; 云服务器维护过程不当,导致云服务器上的健康数据和设备数据被篡改或丢失。 |
基本性能丧失; 病人误诊或延期治疗。 |
| 7.6 | 无法确认使用用户身份 | 移动终端软件使用中,无法对使用的监护对象进行身份确认,导致监护数据和使用者产生匹配错误。 |
基本性能丧失; 病人误诊或延期治疗。 |
(8)企业还应根据自身产品特点确定其他危害。
(9)对采取控制措施后的剩余风险进行估计和评价。
(10)在风险管理计划中,应当赋予具有适当权限的人员以评审的责任。
(八)医疗器械注册证办理产品技术要求应包括的主要性能指标
产品技术要求的审查是产品主要技术性能指标审查中最重要的环节之一。本条款给出需要考虑的产品基本技术性能指标,但并未给出定量要求,企业可参考相应的国家标准、行业标准,根据企业自身产品的技术特点制定相应的技术要求,但不得低于相关强制性国家标准、行业标准的有关要求。
1.制造商拟定的产品技术要求应根据监测的人体生命体征数据覆盖以下标准规定的安全要求和性能要求:
(1)胎儿参数监测:YY/T 0449—2018《超声多普勒胎儿监护仪》GB 9706.9—2008《超声诊断及监护类产品专用安全标准》
(2)心电监测:GB 9706.25—2005《心电监护类设备安全专用标准》YY 1079—2008《心电监护设备安全与性能专用标准》
(3)无创血压监测:YY 0670—2008《无创血压设备性能专用标准》YY 0667—2008《无创血压设备安全与性能专用标准》
(4)血氧监测:YY 0784—2010《脉搏氧设备安全与性能专用标准》
(5)体温监测:YY 0785—2010《电子体温计性能专用标准》(注1)
注1:请关注体温探头采用通过测量人体耳腔的热辐射的工作原理,医疗器械产品注册证办理应考虑执行GB/T 21417.1—2008《医用红外体温计 第1部分:耳腔式》标准的要求;若是采用热敏电阻式的测量方式,请考虑执行YY 0785—2010《临床温度计 连续测量的电子体温计性能要求》标准的要求。
(6)多参数监护的安全要求:YY 0668—2008《医用电气设备 第2部分:多参数患者监护设备安全专用要求》
(7)若有报警功能的安全要求:YY 0709—2009《医用电气设备 第1-8部分:安全通用要求 并列标准:通用要求,医用电气设备和医用电气系统中报警系统的测试和指南》
2.代办医疗器械注册证产品技术要求应包括软件的临床功能纲要(包括数据存储、回顾、管理,报告打印,评分功能、报警功能等,软件功能需参考《医疗器械软件注册技术审查指导原则》的要求)。
若具有网络连接功能用于电子数据交换或远程控制的产品,请参考《医疗器械网络安全注册技术审查指导原则》第五章第(一)款第2条的内容制定性能要求。
若符合移动医疗器械的定义,请参照《移动医疗器械注册技术审查指导原则》充分考虑产品风险及特性,制定相应的性能要求。
3.代办医疗器械产品注册证应在产品技术要求的附录中列明申报产品的所有按医疗器械管理的配附件或影响产品主要性能的配附件信息(如:型号规格、制造商等)。
(九)同一注册单元中典型产品的确定原则和实例
同一注册单元应按产品风险与技术指标的覆盖性确定典型产品。一般来说,典型产品应是同一注册单元内能够代表本单元内其他产品安全性和有效性的产品,即功能最全、结构最复杂和风险最高的产品。在同一注册单元中,若仅辅助功能不同,则可以作为同一产品的多个型号加以区分。
如关键件的不同(如开关电源不同),应进行差异性检验。
如A型号具有一种辅助功能,B型号具有两种以上辅助功能并包括前者,或A型号的性能和功能是B型号的子集,应选取B型号作为典型产品。
与性能和安全项目关注点不同,电磁兼容方面的典型性产品应充分考虑注册单元内不同型号之间电磁兼容特点和差异。
在实施GB 9706.1标准全项检测时,应按照电磁兼容标准要求对电磁兼容性实施检测。安规检测报告和电磁兼容检测报告应具有关联性。
(十)产品生产制造相关要求
1.应当明确产品生产工艺过程,可采用流程图的形式,所提供工艺流程图是否识别并注明主要控制点及关键工艺。
关键工艺及控制点:企业的实际情况各有不同,企业根据生产的具体情况,提交相关的控制点的资料(如:防静电、焊接、老化)。
母亲胎儿监护仪的型式试验的项目应包括产品技术要求的全部项目。
2.有多个研制、生产场地,应当概述每个研制、生产场地的实际情况。
3.企业提交产品关键元器件清单,清单中包括所用关键元器件(如:网电源开关、开关电源、变压器、电源线组件、熔断器座、熔断丝、血氧探头、血压压力传感器、体温探头等)的信息(如:规格型号、制造商等)。技术审评时将该内容写入注册审评报告中。
(十一)产品临床评价细化要求
代理医疗器械注册证依据《医疗器械注册管理办法》(国家食品药品监督管理总局令4号)及《免于进行临床试验的医疗器械目录(修订)》(国家食品药品监督管理总局通告2018年第94号),满足免临床目录描述的母亲胎儿监护仪免于进行临床试验,按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)免临床试验路径的资料要求提供相应的临床评价资料。若有不包括在免临床目录描述范围内的功能,应按照《医疗器械临床评价技术指导原则》(国家食品药品监督管理总局通告2015年第14号)的其他评价路径进行临床评价,提供相应的临床评价资料。
(十二)产品的不良事件历史记录
制造商应关注相关产品的不良事件记录并提供产品的不良事件监测记录。
如上市后发生了召回,应当说明召回原因、过程和处理结果。
(十三)代理医疗器械产品注册证产品说明书、标签要求
说明书、标签、包装标识应当符合《医疗器械说明书和标签管理规定》(国家食品药品监督管理总局令第6号)、YY/T 0466.1—2016《医疗器械用于医疗器械标签、标记和提供信息的符号 第1部分:通用要求》的要求。
由于母亲胎儿监护仪是通过一定量的超声能量作用于人体达到医学监测的目的,在以上的规定和标准中,涉及慎重使用的部分应尽可能详细,清楚,以提示使用者慎重使用。
1.产品说明书至少应包含下列内容:
(1)产品名称、型号、规格。
(2)注册人名称、住所、联系方式及售后服务单位。
(3)生产企业的名称、住所、生产地址、联系方式及生产许可证编号,委托生产的还应标注受托企业的名称、住所、生产地址、生产许可证编号。
(4)医疗器械注册证编号。
(5)产品技术要求的编号。
(6)产品性能、主要结构组成、适用范围。
(7)禁忌证、注意事项、警示以及提示的内容。
(8)安装和使用说明或者图示,由消费者个人自行使用的医疗器械还应当具有安全使用的特别说明(如适用);
(9)产品维护和保养方法,特殊存储、运输条件、方法。
(10)生产日期、使用期限。
(11)配件清单,包括配件、附属品、损耗品更换周期以及更换方法的说明。
(12)产品标签所用的图形、符号、缩写等内容的解释。
(13)说明书的编制或者修订日期。
(14)规定的应当在说明书中标明的其他内容:
a. GB 9706.1—2007《医用电气设备 第一部分:安全通用要求》中6.8条;
b. GB 9706.25—2005《医用电气设备 第2-27部分:心电监护设备安全专用要求》中6.8.2条;
c. YY 0505—2012《医用电气设备 第1-2部分:安全通用要求并列标准 电磁兼容 要求和试验》中6.8条;
d. YY 0668—2008《医用电气设备 第2部分:多参数患者监护设备安全专用要求》中6.8.2条;
e. YY 0670—2008《无创自动测量血压计》中4.2.3条;
f. YY 0667—2008《医用电气设备 第2部分:自动循环无创血压监护设备安全和基本性能专用要求》中6.8.2条;
g. YY/T 0708—2009《医用电气设备 第1-4部分:安全通用要求并列标准:可编程医用电气系统》中6.8.201条、6.8.202条(如适用);
h. YY 0784—2010《医用电气设备 医用脉搏血氧仪设备基本安全和主要性能专用要求》中6.8.2条、6.8.3条、50.101.1条、50.101.2.3条、50.102条、50.103条;
i. GB 9706.9—2008《医用电气设备 第2-37部分:医用超声诊断和监护设备安全专用要求》中6.8.2条、6.8.3条;
j. 其他相关标准及相关指导原则中的说明书编制要求。
2.产品的标签,外部标记中特别是涉及安全使用的部分也应符合法规和相关的标准(如GB 9706系列标准等)。
(十四)产品的研究要求
医疗器械注册咨询根据所申报的产品,应按照《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告2014年第43号)中研究资料的要求提供相应资料。
1.产品性能研究
应当提供产品性能研究资料以及产品技术要求的研究说明,包括功能性、安全性指标以及与质量控制相关的其他指标的确定依据,所采用的标准或方法、采用的原因及理论基础。
2.生物相容性评价研究
直接接触或间接接触孕妇和使用者的材料组成,应当按GB/T 16886.1—2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》规定的原则进行生物相容性评价,并给出清单,提供所有材料的名称和基本成分名称。
监护仪具有多个应用部分,应根据接触性质来进行评价,如应用部分与人体皮肤表面接触,需考虑细胞毒性、皮肤刺激、致敏方面的生物相容性;放置在直肠内的体温探头与粘膜接触,还应考虑材料的粘膜刺激生物相容性。
3.生物安全性研究
如适用。
4.灭菌/消毒工艺研究
若需要终端用户消毒,应当明确推荐的消毒工艺(方法和参数)以及所推荐消毒方法确定的依据。说明书中提供的终端用户消毒工艺应与该研究内容一致。
5.产品有效期和包装研究
有效期的确定应当提供产品有效期信息及确定依据。包装及包装完整性应当提供产品包装的信息,在宣称的有效期内以及运输储存条件下,保持包装完整性的依据。
6.临床前动物试验
如适用,按《关于公布医疗器械注册申报资料要求和批准证明文件格式的公告》(2014第43号)要求进行研究。
7.医疗器械咨询软件研究
软件研究请参见《医疗器械软件注册技术审查指导原则》(国家食品药品监督管理总局通告2015年第50号)的要求。若网络安全适用,按《医疗器械网络安全注册技术审查指导原则》(国家食品药品监督管理总局通告2017年第13号)的要求。若属于移动医疗器械,按《移动医疗器械注册技术审查指导原则》(国家食品药品监督管理总局通告2017年第222号)的要求进行研究。
8.其他研究
对于无创血压监护模块,根据YY 0670—2008《无创自动测量血压计》标准的规定,制造商应提供针对自动血压测量准确性的临床评估报告,YY 0670—2008标准中的附录G推荐了临床方法。
对于血氧监护模块,医疗器械注册办理根据YY 0784—2010《医用电气设备 医用脉搏血氧仪设备基本安全和主要性能专用要求》标准的规定,血氧饱和度准确度的声称应以覆盖整个范围的临床研究测量为支持,功能测试仪或患者模拟器不应并用来确认脉搏血氧仪设备的血氧饱和度的准确度。制造商应提供针对血氧饱和度准确度的临床评估报告,YY 0784—2010标准中的附录EE给出了脉搏血氧饱和度准确度在人体上的评估指导意见。
办理医疗器械注册证对于耳温或额温红外体温计,根据GB/T 21417.1—2008《医用红外体温计 第1部分:耳腔式》标准的规定,制造商应提供针对体温测量的临床准确度与临床重复性的临床评估报告。GB/T 21417.1—2008标准中的附录A给出了临床试验方法。
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械咨询服务公司,专业为广东省及全国各地(西安、汉中、武汉、重庆、成都)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于医疗器械产品注册证代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服