
西安第一类医疗器械生产备案办理根据《医疗器械监督管理条例》(国务院令第650号) 第二十一条 从事第一类医疗器械生产的,由生产企业向所在地设区的市级人民政府食品药品监督管理部门备案并提交其符合本条例第二十条规定条件的证明资料。办理依据:《医疗器械生产监督管理办法》第十一条:开办第一类医疗器械生产企业的,应当向所在地社区的市级食品药品监督管理部门办理第一类医疗器械生产备案,提交备案企业持有的所生产医疗器械的备案凭证复印件和本办法第八条规定的资料(第二项除外)。食品药品监督管理部门应当当场对企业提交资料的完整性进行核对,符合规定条件的予以备案,发给第一类医疗器械生产备案凭证。
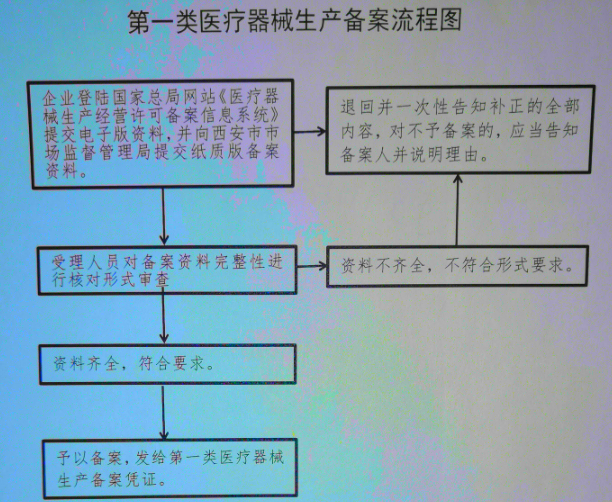
西安第一类医疗器械生产备案办理流程:
西安第一类医疗器械生产备案新办理材料要求:
1、 第一类医疗器械生产备案表
2、申请企业持有的所生产医疗器械备案凭证(第一类医疗器械产品注册证)
3、经备案的产品技术要求(经注册的产品技术要求)
4、营业执照
5、法定代表人、企业负责人身份证
6、生产、质量和技术负责人的身份、学历、职称证明
7、生产管理、质量检验岗位从业人员学历、职称一览表
8、生产场地的证明文件
9、主要生产设备和检验设备目录
10、质量手册和程序文件
11、工艺流程图
12、经办人授权委托书
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(西安、汉中、武汉、重庆、成都)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服