
医疗器械注册备案在西安新办理第一类医疗器械产品备案依据《医疗器械监督管理条例》(国务院令第680号) 第十条第一类医疗器械产品备案,由备案人向所在地设区的市级人民政府食品药品监督管理部门提交备案资料。其中,产品检验报告可以是备案人的自检报告;临床评价资料不包括临床试验报告,可以是通过文献、同类产品临床使用获得的数据证明该医疗器械安全、有效的资料。向我国境内出口第一类医疗器械的境外生产企业,由其在我国境内设立的代表机构或者指定我国境内的企业法人作为代理人,向国务院食品药品监督管理部门提交备案资料和备案人所在国(地区)主管部门准许该医疗器械上市销售的证明文件。备案资料载明的事项发生变化的,应当向原备案部门变更备案。
西安新办理第一类医疗器械产品备案需要的材料目录:
1、第一类医疗器械备案表
2、安全风险分析报告
3、产品技术要求(附产品照片)
4、产品检验报告(加盖企业质检专用章)
5、临床评价资料
6、产品说明书及最小销售单元标签设计样稿
7、生产制造信息
8、证明性文件(营业执照)
9、符合性声明
10、经办人授权委托书
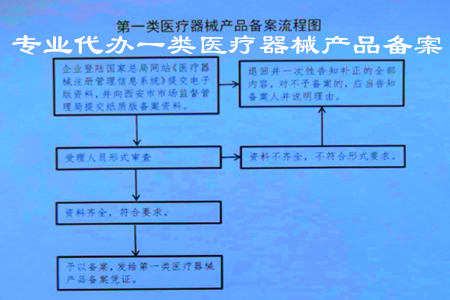
西安新办理第一类医疗器械产品备案流程图:
受理条件
符合行政法规规定的相关条件。
一类医疗器械产品备案最快多长时间下证?
按照药监局承诺办结时限:1个工作日,但因办理企业多,需排队受理,一般最快需7个工作日。
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(西安、汉中、武汉、重庆、成都)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于国内医疗器械产品注册证、体外诊断试剂注册、进口医疗器械注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报、医疗器械出口销售证明办理等提供一站式服务公司,欢迎您咨询与合作!


 在线客服
在线客服