
医疗器械注册电动手术台产品注册技术要求应包括的主要技术指标应包括基本尺寸、性能指标、环境条件和安全要求五部分。本条款列举的基本技术指标为典型电动手术台和附件指标,企业应参考YY/T 1106-2008等国家标准、行业标准,并结合临床需求、自身产品的技术特点对各项指标的具体参数做出规定。
1.基本尺寸
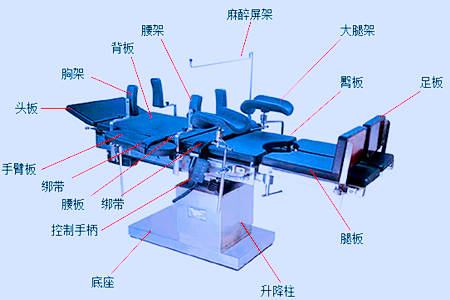
床体:台面长度、台面宽度(含钢轨/不含钢轨)、整体高度(最低位置,含床垫/不含床垫)。
附件:附件的关键几何尺寸(长、宽、高、直径、角度)。
2.性能指标
床体:
2.1 运行参数一般包含台面升降行程、台面纵向倾斜、台面横向倾斜、头板折转角度、背板折转角度、腰板升高高度范围、腿板折转角度、台面纵向平移、台面旋转等。
2.2 渗漏(若适用)。
2.3 动作平稳性。
2.4 台面摆动量。
2.5 装卸方便性。
2.6 X射线透过性(若适用)。
2.7 控制器按键功能。
2.8 外观。
医疗器械产品注册附件:根据不同附件的具体情况做出相应要求,如:术中牵引架的行程范围、调整范围等。
注:若头板、背板、腿板、足板等存在更换延长板的情况,应重点关注更换延长板后产品的性能指标变化。
3.环境条件
医疗器械注册代理按GB/T 14710-2009的规定进行试验后,电动手术台的所有性能应符合要求。
4.安全要求
4.1 电气安全要求
电动手术台产品安全通用要求应符合GB 9706.1-2007的规定。
电动手术台产品安全专用要求应符合YY0570-2013的规定。
4.2 电磁兼容性要求
医疗器械产品注册代理电动手术台产品电磁兼容性要求应符合YY 0505-2012的相关要求。
产品适用的相关标准,医疗器械注册产品标准号标准名称:
GB/T 191-2008《包装储运图示标志》
GB 9706.1-2007 《医用电气设备 第1部分:安全通用要求》
GB/T 14710-2009《医用电气设备环境要求及试验方法》
YY/T 0316-2008《医疗器械 风险管理对医疗器械的应用》
YY 0505-2012《医用电气设备 第1-2部分:安全通用要求并列标准 电磁兼容 要求和试验》
YY 0570-2013《医用电气设备 第2部分 手术台安全专用要求》
YY/T 1106-2008《电动手术台》
YY 91057-1999《医用脚踏开关通用技术条件》
注:以上标准适用最新版本
医疗器械注册代办上述标准包括了产品技术要求和其他相关材料中经常涉及到的标准,注册申请人应关注上述国家标准和行业标准的有效性。有的注册申请还会根据产品的特点引用一些行业外的标准和一些较为特殊的标准。
深圳鸿远医疗器械咨询服务公司, 是一家技术专业的医疗器械注册咨询服务公司,专业为广东省及全国各地(西安、汉中、武汉、重庆、成都)等地区的医疗器械生产、销售企业提供技术咨询服务。深圳鸿远医疗器械咨询专注于专业专注于医疗器械产品注册代办理咨询、一类医疗器械产品备案代办、医疗器械产品分类界定代办理、代办医疗器械生产许可证、一类医疗器械生产备案代办、医疗器械经营许可证代办、二类医疗器械经营备案、进口医疗器械注册、CE认证、ISO13485认证、FDA注册、FDA认证、临床试验、医疗器械质量管理体系认证及体系建立与过程确认文件建立(ISO9001, ISO13485, GMP, CE,QSR820,CMDCAS);注册、出口证、自由销售证办理、产品技术要求制订、技术文件、临床试验及免临床同类产品对比资料编写、注册资料编写辅导、电磁兼容预测整改、医疗器械广告批文申报等提供一站式服务公司,欢迎您咨询与合作!

 在线客服
在线客服